艾滋病主要病因
艾滋病主要病因
艾滋病的致病机制与人类免疫缺陷病毒的入侵及对免疫系统的持续性破坏密切相关,其核心病因可归结为病毒对CD4+T淋巴细胞的特异性攻击、免疫系统功能渐进性衰竭以及病毒基因组的整合与潜伏感染。以下从三个层面展开分析:

一、CD4+T淋巴细胞靶向破坏:免疫系统的“核心漏洞”
HIV通过病毒包膜蛋白gp120与CD4+T淋巴细胞表面的CD4受体结合,同时借助辅助受体完成病毒膜与细胞膜的融合,进而将病毒RNA注入细胞。在逆转录酶作用下,病毒RNA转化为DNA并整合至宿主细胞基因组,形成“前病毒”。当宿主细胞被激活时,前病毒DNA可转录为新病毒颗粒,导致细胞破裂死亡。
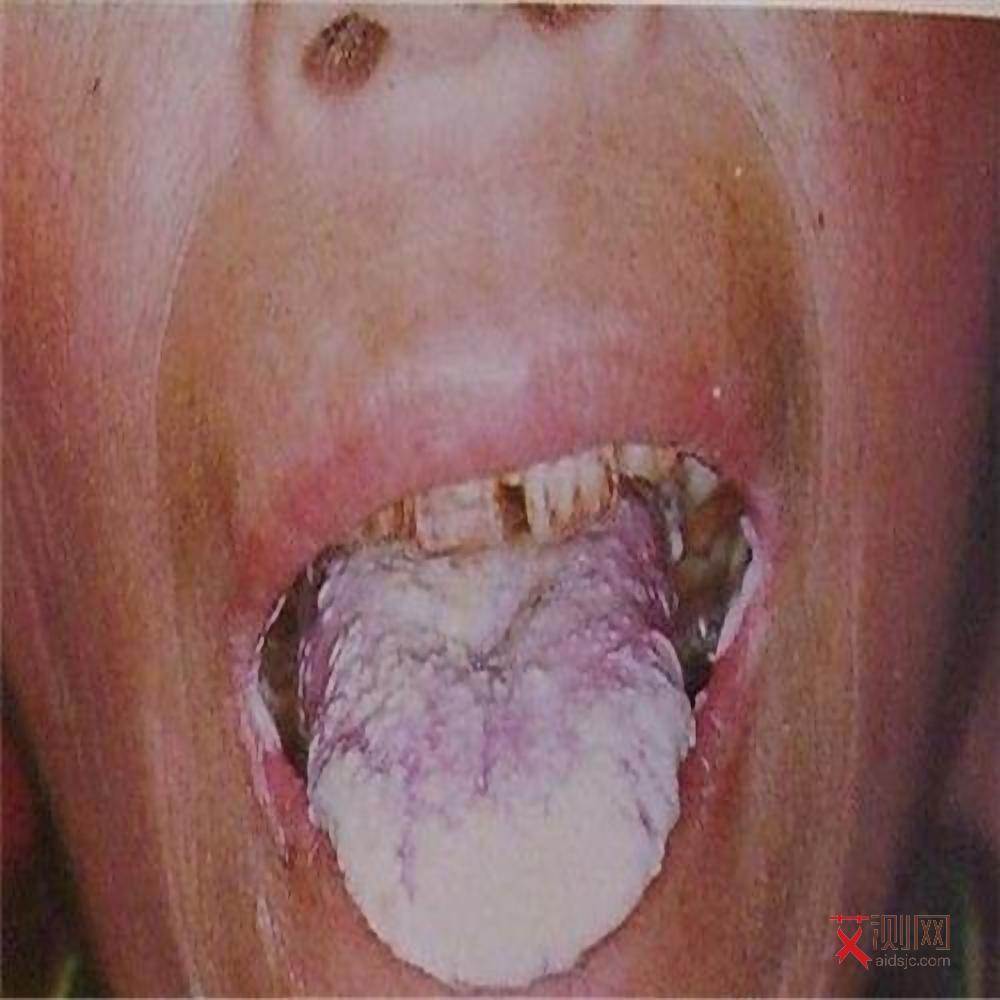
CD4+T淋巴细胞是免疫系统的“指挥中枢”,负责协调B细胞抗体产生、巨噬细胞吞噬功能及CD8+T细胞杀伤作用。HIV对CD4+T细胞的持续杀伤,直接导致免疫系统“指挥失灵”,使机体对机会性感染和恶性肿瘤的防御能力崩溃。临床数据显示,当CD4+T细胞计数降至200个/μL以下时,艾滋病相关机会性感染的发生率显著上升。
二、病毒基因组整合与潜伏感染:免疫逃逸的“隐形炸弹”
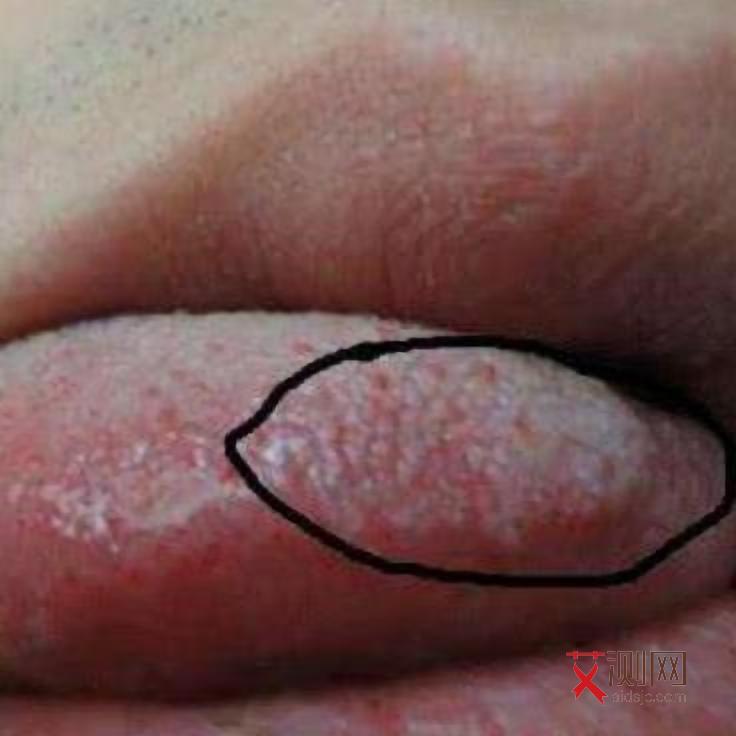
HIV的整合酶可将病毒DNA随机进入宿主细胞基因组,形成稳定的潜伏感染库。潜伏感染的细胞表面不表达病毒抗原,可逃避宿主免疫系统和抗病毒药物的识别,成为病毒持续存在的“避难所”。
即使通过高效抗逆转录病毒治疗将血浆病毒载量降至检测不到的水平,潜伏感染库仍可能持续存在。一旦治疗中断或免疫功能下降,潜伏病毒可重新激活,导致病毒反弹。这种“潜伏-激活”循环是艾滋病难以彻底治愈的根本原因,也是患者需终身服药的关键因素。
三、免疫系统慢性激活与炎症损伤:病情进展的“加速剂”
HIV感染不仅直接破坏CD4+T细胞,还会通过慢性激活免疫系统导致免疫功能紊乱。慢性炎症可促进淋巴细胞凋亡、抑制胸腺新生T细胞生成,并加速免疫衰老。
此外,病毒蛋白可干扰宿主细胞正常功能,诱导细胞因子风暴,进一步加剧组织损伤。这种“免疫激活-炎症损伤”的恶性循环,是艾滋病患者并发心血管疾病、神经认知障碍和代谢综合征的重要诱因。
恐艾人群的检测选择:DNA核酸检测的“7天排除”优势
对于存在高危行为且处于焦虑状态的恐艾人群,HIV DNA核酸检测是早期排除感染的最优选择。与传统的RNA核酸检测和抗体检测相比,DNA核酸检测具有以下优势:
1. 窗口期短:感染后7天即可通过检测外周血单核细胞中的HIV前病毒DNA排除感染,避免长期焦虑;

2. 准确性高:直接检测病毒基因组,不受抗体产生延迟或病毒载量波动影响;
3. 临床意义重大:早期排除可避免延误治疗时机。若等待抗体检测结果,病毒可能已完成大量复制,导致病毒库扩大,后续治疗需更长时间抑制病毒,且免疫重建难度增加。研究表明,病毒库越大,患者对治疗的响应越差,治疗费用越高,预期寿命越短。

建议:恐艾人群应在高危行为后7天进行HIV DNA核酸检测,若结果为阴性,可基本排除感染;若阳性,需立即启动抗病毒治疗。避免因等待抗体检测或普通RNA检测而错过早期干预窗口。



